Accesso al binario 9 ¾ alla stazione di King’s Cross, Londra: per accedervi bisogna passare attraverso un muro.
(M. Süßen/Commons CC–BY–SA–3.0)
Quanti di noi non hanno sognato le avventure di Harry Potter da quando nel 1997 la Rowling ha pubblicato il primo della serie di libri che hanno avuto tanto successo? Si tratta delle avventure di un mago, Harry Potter appunto, che si inquadrano nella classica disfida tra bene e male. Fin da subito ci si immerge in un mondo fatato grazie al quale si può sognare ad occhi aperti. Certo nessuno si illude più di tanto. Tutti sanno che le motociclette non possono volare, che non è possibile che un essere umano possa inforcare una scopa ed usarla come mezzo di trasporto volante, oppure che gli alberi si muovano o i ragni parlino. Ma più di ogni altra cosa, tutti sanno che non è possibile attraversare i muri come quello che i protagonisti delle storie della Rowling si trovano ad attraversare quando devono prendere il treno per andare nella famosa scuola di Hogwart
.

L’espresso per Hogwart: in realtà è il viadotto Glenfinnan sulla West Highland Line, in Scozia.
(Benutzer:Nicolas17/Commons CC–BY–SA–2.5)
Che noi non possiamo attraversare gli oggetti (ed i muri in particolare) è un fatto acclarato. Se ci provassimo non faremmo altro che procurarci un qualche tipo di trauma. Lo impariamo fin da piccoli quando cominciamo a camminare e cominciamo a dare le prime capocciate ai muri nel tentativo di andare dove non è possibile. Però sarebbe bello poter attraversare un corpo! Si eviterebbero tanti incidenti mortali. Potrebbe essere utile, per esempio, quando si attraversano le strade a Palermo. Lo si farebbe senza patemi, senza temere in ogni istante di essere investito da qualche automobilista indisciplinato (ed a Palermo la media degli automobilisti è indisciplinata!). Fin da quando andiamo a scuola ci viene spiegato che esiste un principio fondamentale della fisica che consiste nella incompenetrabilità dei corpi, ovvero i corpi (oggetti fisici che occupano uno spazio e sono costituiti da massa) non possono penetrare l’uno nell’altro: un corpo può occupare tutto lo spazio possibile eccetto quello occupato da un altro corpo. Sembra un fatto ovvio, cioè del tutto intuitivo: se io sono un oggetto dotato di massa e occupante una porzione di spazio, non posso trovarmi nella porzione di spazio occupata da un altro corpo dotato anche esso di massa. Quello che non ci viene detto a scuola è che la spiegazione del principio di incompenetrabilità dei corpi, benché antichissimo, è stato compreso appieno solo all’inizio del XX secolo.

Lo scrittore francese Marcel Aymé passa attraverso un muro: monumento dedicato al suo romanzo Le passe-muraille (Il passa-mura) a Montmarte, Parigi.
(© Depositphotos)
Cosa è accaduto tra la fine dell’ottocento e la prima metà del ‘900 per permetterci di capire, dopo millenni, il meccanismo alla base della impenetrabilità dei corpi? C’è stata una vera e propria rivoluzione scientifica che oggi conosciamo come “rivoluzione quantistica”, ovvero è nata la meccanica quantistica (MQ). La meccanica quantistica è un complesso insieme di conoscenze attraverso cui si cerca di spiegare il comportamento dei sistemi microscopici. Nasce per opera di un gruppo di scienziati che tutti assieme, ma indipendentemente gli uni dagli altri, realizzarono che le leggi di Newton (che oggi tutti conosciamo come meccanica classica) non erano applicabili nel mondo microscopico. Hertz, Rutheford, Thomson, Bohr, Dirac, Curie, Heisenberg, Schroedinger, de Broglie, Einstein, Born, Planck, Pauli e tanti altri capirono che il comportamento delle particelle a livello microscopico era interpretabile in base a leggi statistiche, ovvero probabilistiche, piuttosto che in base alle leggi deterministiche come quelle elaborate quattro secoli prima da Isaac Newton. Uno dei risultati più eclatanti derivati dalla MQ è stata la comprensione della natura dell’atomo la cui esistenza fu postulata dai filosofi pre-socratici già nel VI secolo a.C: Leucippo, Democrito ed Epicuro. La visione atomistica dei pre-socratici si basava sull’intuizione che un qualsiasi oggetto poteva essere diviso in tante parti. Ognuna di esse poteva essere divisa in più parti e così via di seguito fino al momento in cui le parti ottenute risultavano così piccole da non poter essere più suddivise. Se ci pensiamo bene, questa idea atomica si basava sull’uso del coltello (oggetto con una certa dimensione) che consentiva di dividere un oggetto ad una dimensione non inferiore a quella del coltello stesso. Le parti indivisibili ottenute con coltellini sempre più piccoli, contenevano la “qualità” dell’oggetto sotto analisi. In altre parole, i pre-socratici ritenevano che esistesse una particella prima da cui poi potesse crearsi la materia. In questo modo si distinguevano tantissimi “atomi”: l’atomo della roccia, quello dell’albero, quello del metallo di una spada e così via di seguito. Dopo circa ventisei secoli, il concetto di atomo, così come il numero potenzialmente infinito di essi nella concezione pre-socratica, è stato completamente rielaborato. Oggi è ben noto che il numero di atomi è pari a 118, ovvero quanti sono gli elementi della tavola periodica. Tuttavia, bisogna aggiungere che, di questi, solo una cinquantina sono così stabili da costituire tutta la materia che conosciamo e soltanto cinque/sei sono i più abbondanti sulla Terra (ossigeno in testa).

Atomo di elio: l’orbita dell’elettrone è una “nuvola” costituita dalle probabili posizioni dell’elettrone.
Come è fatto un atomo? L’atomo non è indivisibile. È fatto da subparticelle che si chiamano protoni, neutroni ed elettroni. Queste sono, a loro volta, fatte da altre subparticelle. Tuttavia, per lo scopo prefisso qui, ci fermiamo. Non andiamo oltre. Protoni e neutroni formano un agglomerato che chiamiamo nucleo. Attorno al nucleo ruotano gli elettroni. Il concetto di “ruotare”, in realtà, è sbagliato. Infatti, esso implica un movimento circolare ben definito. Gli elettroni non “ruotano” intorno al nucleo (come viene insegnato erroneamente a scuola) ma si “muovono” intorno ad esso. Come si muovono? Non si sa. Si sa, comunque, che in un dato istante gli elettroni si trovano in una certa porzione di spazio mentre nell’istante successivo possono stare da tutt’altra parte. Come ci sono arrivati? Non si sa. Ecco, se proprio volessimo fare un parallelismo, per quanto ci è dato sapere fino ad ora, gli elettroni sono degli oggetti magici, della stessa magia usata da Harry Potter, che si muovono sparendo e riapparendo in continuazione in uno spazio ben definito intorno al nucleo che abbiamo deciso di chiamare “orbitale”. La magia che consente agli elettroni di comportarsi come descritto si chiama “principio di indeterminazione di Heisenberg”. Cosa dice questo principio? Dice semplicemente che quando passiamo dal macroscopico al microscopico non possiamo conoscere con la stessa precisione sia la posizione che la quantità di moto associata alla particella microscopica.

Werner Karl Heisenberg, premio Nobel per la fisica nel 1932. (Bundesarchiv, Bild183-R57262 / CC-BY-SA 3.0)
La bellezza del principio di Heisenberg sta nel fatto che è grazie ad esso che noi possiamo dire che due atomi differenti sono indistinguibili l’uno dall’altro come due gemelli monozigoti. Anzi, le particelle microscopiche sono ancora più uguali dei gemelli anzidetti. Infatti, benché identici, i gemelli monozigoti hanno tante caratteristiche che ne permettono l’identificazione come, per esempio, impronte digitali o gruppo sanguigno. Invece nel mondo microscopico i gemelli hanno tutto uguale, dal gruppo sanguigno alle impronte digitali. Affinché due oggetti microscopici possano essere differenziati è necessario che ci sia almeno qualcosa che cambi tra loro. Quindi, un atomo di ossigeno è distinto e riconoscibile dall’altrettanto microscopico atomo di azoto perché il primo contiene 8 protoni e 8 elettroni, mentre il secondo contiene 7 protoni e 7 elettroni. La differenza nel numero delle componenti subatomiche fa anche in modo che i due corpi abbiano massa differente. Rimane sempre valido, però, il principio della indistinguibilità microscopica tra sistemi simili: due atomi di ossigeno o due atomi di azoto, così come due elettroni, due protoni o due neutroni sono assolutamente identici, per cui scambiandone la posizione non saremo in grado di dire chi è l’uno e chi è l’altro. Abbiamo appena visto che il principio di indeterminazione ci permette di dire che non esiste differenza tra gli elettroni contenuti in un atomo. Sono tutti uguali ed indistinguibili. Tuttavia, come si dispongono attorno al nucleo? Abbiamo detto che vanno ad occupare uno spazio che si chiama orbitale. Di conseguenza, sulla base di questa unica informazione, ne ricaviamo che in un elemento come il carbonio che ha 6 elettroni, questi ultimi si “affollino” tutti nella stessa porzione di spazio. Molto semplicisticamente, adesso proviamo a pensare ad una stanza di 2 x 2 m nella quale facciamo entrare 6 persone. Le sei persone devono suddividersi uno spazio di 4 m², ovvero hanno circa 0.67 m² ciascuno in cui poter stare. In altre parole, ogni individuo deve stare in un quadrato di circa 80 cm di lato. Un po’ poco direi. Se poi a questo aggiungiamo che le persone si muovono, allungano le braccia, si stiracchiano e fanno tutti quei movimenti che ognuno di noi fa anche senza rendersene conto, ne viene che una stanza di 4 m² non è sufficiente a far star comode sei persone (in realtà non è neanche comoda per una sola persona, ma non è questo il punto adesso).
Adesso immaginiamo che le persone siano gli elettroni del carbonio e la stanza sia l’orbitale di cui abbiamo parlato; aggiungiamo che gli elettroni sono cariche elettriche (negative) tutte uguali e ricordiamo che cariche elettriche dello stesso segno si respingono; ne viene che 6 elettroni assieme non stanno molto bene nella stessa porzione di spazio. Essi tenderanno a starsene solitari e quanto più possibile lontani gli uni dagli altri. In effetti, i cavalieri della meccanica quantistica (già nominati sopra) hanno potuto stabilire il principio dell’Aufbau o della distribuzione elettronica. In base a tale principio, quando un elemento contiene molti elettroni, essi tendono a distribuirsi a distanze diverse dal nucleo occupando spazi (ovvero orbitali) che differiscono tra loro sia per forma che per dimensioni. La cosa interessante, però, è che ogni orbitale non può contenere più di due elettroni. Essi, inoltre, devono essere distinguibili tra loro. Insomma, elettroni uguali in tutto e per tutto non stanno bene assieme nella stessa stanza. Se in base al principio di indeterminazione gli elettroni sono indistinguibili, come mai si è arrivati a dire che un orbitale non può contenere più di due elettroni diversi? Sulla base di cosa riusciamo a distinguere due elettroni? Oltre a carica e massa, gli elettroni hanno anche un’altra proprietà che è stata chiamata spin. Non è facile descrivere lo spin. L’omologia che meglio rende l’idea è quella di un pallone lanciato verso la porta. Il pallone può ruotare in una direzione, per esempio in senso orario, ed avere un effetto che ne sposta la direzione verso destra oppure può ruotare nella direzione opposta, ovvero in senso antiorario, per cui si sposta, nel suo moto, verso sinistra. Ecco. Un elettrone può essere approssimato ad un pallone in rotazione dopo essere stato calciato verso la porta. Può trovarsi in due stati incompatibili tra loro (o ruota in un senso o nell’altro) e nello stesso tempo indistinguibili. L’indistinguibilità di cui si accenna è legata al fatto che fino a che non venga fatta una misurazione diretta, non si può sapere quale dei due elettroni in un orbitale abbia uno spin oppure l’altro. E, comunque, anche quando assegniamo in modo univoco lo spin elettronico, il principio di indeterminazione rimane soddisfatto perché all’atto della misurazione dello spin, non siamo in grado di dire se la posizione dell’elettrone in oggetto (chiamiamola D) sia stata raggiunta lungo il percorso A-D (dove A è la posizione dell’elettrone 1) o lungo il percorso B-D (dove B è la posizione dell’elettrone 2). In altre parole ancora non sappiamo di quale dei due elettroni stiamo misurando lo spin. Sappiamo solo che due elettroni aventi carica e massa uguale non possono avere lo stesso spin se vogliono condividere lo stesso orbitale.
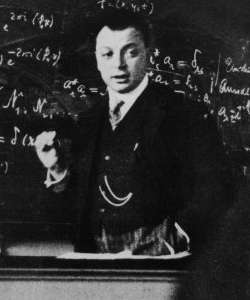
Wolfgang Pauli
La legge dell’Aufbau prevede che un insieme di elettroni occupi tutto lo spazio a disposizione (principio di Hund) in modo tale che nella stessa porzione di spazio (orbitale) non possano coesistere più di due elettroni, distinguibili tra loro per avere spin opposti (principio di Pauli): questo spiega perché quando tentiamo di fare come Harry Potter e corriamo verso un muro, piuttosto che attraversarlo, prendiamo una sonora capocciata. Molto semplicisticamente, attraversare un muro (o un oggetto, in generale) significa che gli orbitali presenti negli atomi che compongono l’oggetto X (il muro) devono sovrapporsi con quelli presenti negli atomi che compongono l’oggetto Y (la nostra testa). Tuttavia, dal momento che tutti gli orbitali sono occupati da una coppia di elettroni con spin opposto, ne viene che sovrapporre un orbitale all’altro implicherebbe generare uno spazio con quattro elettroni a due a due uguali in tutto, incluso lo spin. Questa ultima situazione viola la regola Aufbau e, più in particolare, il principio di Pauli (cuore portante dell’anzidetta regola). Qual è la conclusione? Continuiamo a vedere i film di Harry Potter ed a leggere i libri della Rowling (beneficiando della sospensione dell’incredulità.) Tuttavia, teniamo ben presente che le leggi fisiche inquadrate molto bene dalla quantomeccanica non possono essere violate semplicemente continuando a battere la testa sul muro. In questo caso l’unico risultato possibile è un trauma cranico e un muro scheggiato.
Ad altre puntate la demistificazione di fenomeni che appaiono magici.
Letture consigliate
-
Lederman e Hill
Fisica quantistica per poeti -
Manjit Kumar
Quantum -
Silvia Arroyo Carmejo
Il bizzarro mondo dei quanti